近日,食品科学与工程学院罗欣教授团队梁荣蓉副教授在《Food Chemistry》在线发表了题为“Multispectral and molecular dynamics study on the impact of trans, trans-2,4-decadienal and 4-hydroxy-2-nonenal on myoglobin redox stability”的研究论文。博士研究生齐家静和杨啸吟副教授为该论文共同第一作者,梁荣蓉副教授为该论文通讯作者。
肉色是消费者判断肉类新鲜程度的重要品质指标,而脂质氧化会通过醛、酮等次级代谢产物促进肌红蛋白氧化,从而导致肉色劣变。在这些脂质氧化产物中4-羟基-2壬烯醛(HNE)具有较强的促进肌红蛋白氧化的作用,而这方面已进行了大量研究。但是脂质氧化产物众多,其分子结构和反应活性等不同。目前鲜有其它氧化产物与肌红蛋白作用的报道。脂质氧化产物反式,反式– 2,4-癸二烯醛(tt-DDE)具有较强的反应活性,该团队猜测其具有更强的促肉色劣变作用,但是目前尚未见该方面的报道,这极大地限制了人们对脂质氧化加剧肉色劣变的认识,不利于肉色的控制。因此,本研究通过体外实验探究了tt-DDE对肌红蛋白的氧化作用及其对肌红蛋白分子结构的影响,揭示了tt-DDE加剧肉色劣变的潜在机制,为生鲜肉类肉色稳定性的改善提供了理论依据。
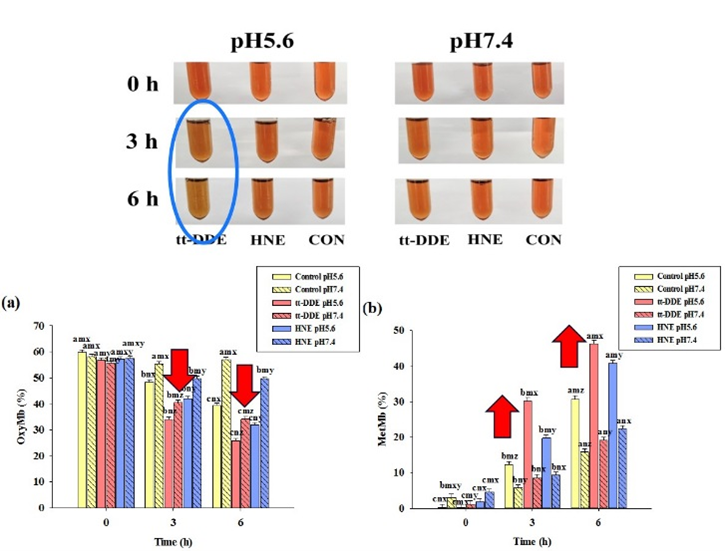
图1 HNE和tt-DDE对肌红蛋白的促氧化作用及对其化学状态的影响
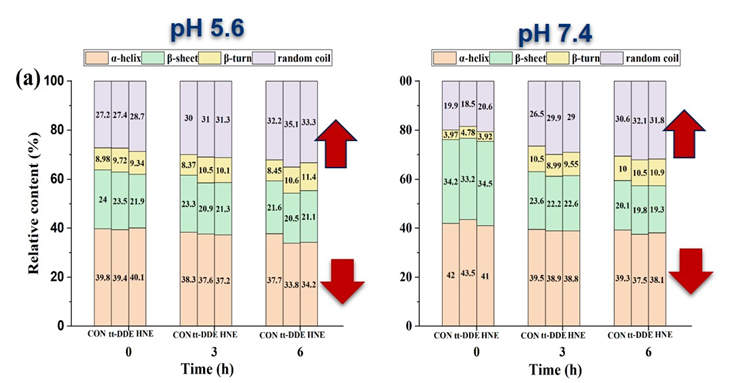
图2 HNE和tt-DDE对肌红蛋白二级和三级结构的影响
表1 HNE和tt-DDE对肌红蛋白分子疏水性的影响
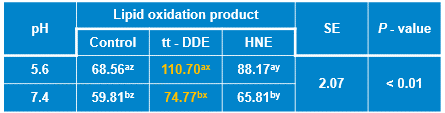
该研究发现,tt-DDE对肌红蛋白的促氧化作用强于HNE,能与肌红蛋白形成较稳定的复合物,使肌红蛋白产生较强的静态淬灭;能破坏肌红蛋白的二级和三级结构,促进其氧化进程。分子对接结果显示tt-DDE和HNE均能与肌红蛋白的血红素基团紧密结合,均与肌红蛋白的Val67、Thr70、Ala71、Leu89、Pro88和血红素基团之间存在疏水作用力,但tt-DDE还能与肌红蛋白的Ser92存在氢键作用力。因此,tt-DDE和HNE均会破坏肌红蛋白结构稳定性,促进血红素铁的氧化,从而导致肉色劣变,但是tt-DDE与肌红蛋白的作用强于HNE,且促肌红蛋白氧化能力也强于HNE。
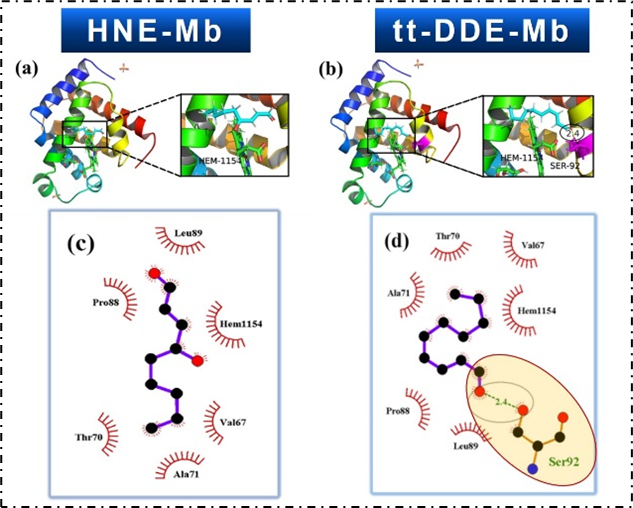
图3. 肌红蛋白与HNE和tt-DDE的分子对接
该研究首次证明了tt-DDE是促进肌红蛋白氧化的另一种重要脂质氧化产物,并探究了其对肌红蛋白结构的影响,进一步揭示了脂质氧化加剧肉色劣变的机制。
该研究得到了国家自然科学基金、国家现代农业技术体系建设专项基金、山东省现代农业技术体系建设专项基金、中央引导地方科技发展专项基金的资助。
论文链接:https://doi.org/10.1016/j.foodchem.2023.137366
编 辑:万 千
审 核:贾 波









